5xFAD(五转)五转家族性阿尔茨海默病模型小鼠
一、疾病概述
阿尔茨海默病(Alzheimer’s disease, AD)是较常见的神经退行性疾病,也是比较常见的痴呆疾病(dementia),随年龄的增长其发病率逐渐增加。阿尔茨海默病的致病机制尚不明确,主要分为家族性阿尔茨海默病(familial AD, FAD)和散发性阿尔茨海默病(sporadic AD, sAD)。疾病的病理表现集中在神经元之间的淀粉样蛋白斑块沉积,神经元细胞内的磷酸化Tau蛋白和神经原纤维缠结,海马区和新皮层区弥散性的神经元丢失。
阿尔茨海默病(Alzheimer’s disease, AD) 临床症状主要为记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现,起病隐匿,呈进行性发展。 病理表现主要为脑组织萎缩、神经纤维缠结、老年斑形成和大量淀粉样蛋白沉积。 发病机制尚不明确,从目前研究来看,该病的可能因素和假说多达30余种,主要发病机制假说包括Aβ毒性假说,Tau蛋白代谢异常,神经炎症,胆碱能损伤,金属离子代谢紊乱,糖脂代谢紊乱,自由基损伤,神经血管功能失调,线粒体功能紊乱,兴奋性氨基酸毒性、病毒感染等。
由于 AD 的病因与机制的复杂性,研究人员试图通过多种方法建立多因素作用的 AD 动物模型。遗传学研究提供了更多的 AD 致病基因,使人们能设计和制备出新的同时转入多个基因的 AD 模型小鼠。通过对已存在的 AD 转基因小鼠相杂交、附加额外的基因等技术创造转双基因或多基因的小鼠,可以更加接近 AD 的真实病理学变化,并可以对不同 AD 相关因素的相互作用进行研究。对研究 AD的病因、发病机制和探索相应的治疗药物非常有利。
国内外相关的研究团队和学者一直在探索建立转多基因的 AD 动物模型中,携带 5 个家族性基因突变的 APP /PS1 AD 转基因模型小鼠 ( transgenic mice with five familial Alzheimer's disease,5 × FAD) 为近期较新的 AD 模型小鼠,该小鼠具有 AD 相关的 5 个突变位点,其中与 APP 相关的突变为 K670N/M671L( Swedish) 、I716V ( Florida) 和 V717I ( London) ,与PS1 相关的突变为 M146L 和 L286V。这些突变可以增加 Aβ42 的生成和促进 AD 的发病,是在 APP /PS1 转基因模型小鼠的基础上更加接近临床 AD 病理特征的新的 AD 模型。
二、基本信息

品系名称:B6.CgTg(APPSwe,APPf1,APPlon,PSEN1M146L,PSEN1L286V)6799Vas/Mmjax
别名:5XFAD, Tg6799, Tg-5xFAD
物种:小鼠
转基因:APP,PSEN1
突变:APP K670_M671delinsNL (Swedish) ,APP I716V (Florida),APP V717I (London),PSEN1 M146L (A>C),PSEN1 L286V
编辑类型:APP - 转基因;PSEN1 - 转基因
疾病相关:阿尔茨海默病
遗传背景:C57BL/6
构建策略:表达5个与AD相关的突变
突变的APP:K670N / M671L(瑞典)、I716V(佛罗里达)、V717I(伦敦);
突变的PSEN1:M146L、L286V
这些转基因小鼠是通过共注射两个编码APP(带有瑞典型K670N/M671L,佛罗里达型I716V和伦敦型V717I突变)和PSEN1(带有M146L和L286V突变)的载体,每个载体由小鼠Thy1启动子驱动制成的。转基因插入到单个位点Chr3:6297836 (Build GRCm38/mm10),不影响任何已知基因 (Goodwin et al., 2019)。初代杂交的B6SJL背景的小鼠已被回交至C57BL6小鼠至少五代。
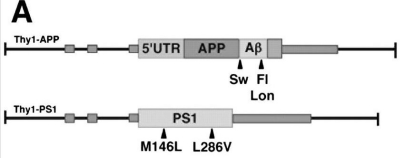
5xFAD转基因示意图
Oakley et al., J Neurosci. 2006
5xFAD小鼠表达人类APP和PSEN1转基因,共有五个与 (Alzheimer's Disease, AD) 相关的突变:APP的瑞典型(K670N/M671L),佛罗里达型(I716V)和伦敦型(V717I)突变,以及PSEN1的M146L和L286V突变。5xFAD小鼠初代在B6SJL杂交背景上创建(此遗传背景小鼠的介绍见5xFAD (C57BL6xSJL))。然而,许多实验室更喜欢使用C57BL/6背景的小鼠,并且通过回交已经产生了自己的同源近交系。The Jackson Laboratory提供C57BL/6J背景的5xFAD小鼠。
此文的描述是指杂合APP和PSEN1转基因小鼠。与杂合5xFAD小鼠相比,纯合小鼠表现出更严重的淀粉样病理;行为缺陷也更严重和/或具有更早的发病年龄(Richard et al.,2015)。
★双转、三转、五转鼠差别
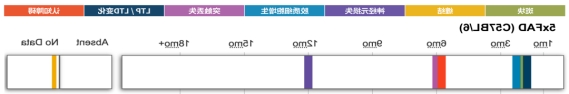
病理、电生理、行为学指标出现的时间点不同(单位:月)
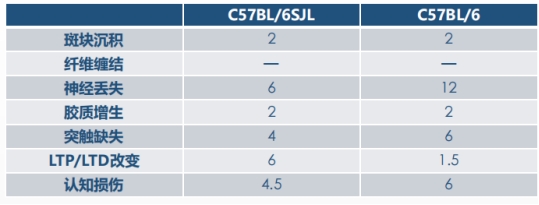
数据来源于https://www.alzforum.org/
5xFAD (B6SJL)。这是初代的5xFAD品系,为B6SJL杂交背景。在公开的报道中,B6模型的表型略于B6SJL(几乎所有的纯背景AD模型表型都弱于混合背景)。B6模型更便于回交,大规模的B6SJL来做毒理(800只规模)在国内非常困难。
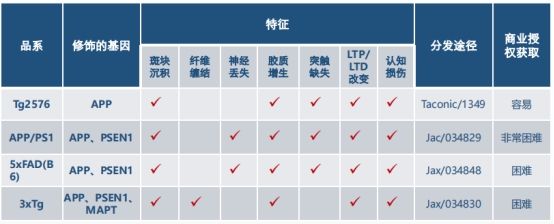
三、特点
淀粉样蛋白斑块(Amyloid plaques)是β-淀粉样蛋白(β-amyloid, Aβ)的沉积,是AD的典型病理特征。
淀粉样前体蛋白(Amyloid precursor protein, APP)属于I型跨膜蛋白,人类APP基因位于21号染色体,共18个外显子,约100~130kb。研究发现APP可在神经系统发育过程中发挥重要功能,但具体生理作用尚未清楚。APP可被α-,β-和γ-分泌酶(secretase)剪切,形成细胞外α-,β-和γ-淀粉样蛋白的病理特征。APP基因的突变与早发性家族性AD(familial AD, FAD)密切相关.
Aβ蛋白是APP的水解形式,需要经过β-和γ-分泌酶(secretase)的剪切。首先,β-分泌酶剪切APP形成Aβ的N端,得到膜结合片段C99和分泌型APP胞外域APPsβ。随后,C99经γ-分泌酶剪切,产生Aβ的C端。γ-分泌酶的剪切不是精确剪切,可生成一系列Aβ多肽,其长度分别为38-43个氨基酸不等。一般情况下产生的Aβ40较多,Aβ42较少。Aβ42蛋白与短的Aβ蛋白相比更易产生纤维,Aβ42浓度增加与淀粉样蛋白斑块的不溶性纤维形成有关。已有大量证据表明早发型家族性AD与Aβ42蛋白相关,提示Aβ42在AD过程中发挥病因学作用。常染色体显性突变的APP、PS1、PS2基因与Aβ42蛋白的表达增高有关,并引起FAD。FAD中突变型的APP容易出现在β-或γ-分泌酶结合位点附近的聚集,导致Aβ总量增加。PS1和PS2是γ-分泌酶复合体的亚基,FAD的早老素presenilin突变也促进Aβ42增加。
(一)表型概览
1、斑块
观察到海马、皮质、丘脑和脊髓中的淀粉样斑块。5 × FAD 小鼠模型 Aβ 生成明显增加,研究表明 5×FAD 小鼠迅速并且持续地产生中枢内 Aβ42的聚集,神经元细胞内的Aβ42蛋白自1.5月龄起出现,先于淀粉样蛋白斑块形成,主要定位于神经元的胞体和突起。随着小鼠月龄增长,Aβ42蛋白表达几乎呈线性增加。2月龄起出现淀粉样蛋白沉积和胶质细胞增生,特别是在海马下托和皮层深部。6月龄时可见大量蛋白沉积。9月龄时,CDK5活化亚基p25表达增加。
2、缠结
无数据。
3、神经元损失
皮层V层的大锥体神经元和下托的神经元丢失。12月龄时,第V层锥体神经元大约损失40%。
4、胶质增生
小胶质细胞增生和星形胶质细胞增生与淀粉样斑块相关。小胶质细胞增生与血管损伤相关。
5、突触损失
与仅表达黄色荧光蛋白(YFP小鼠)的小鼠相比,5xFAD小鼠与表达黄色荧光蛋白(YFP小鼠)的小鼠杂交后,体感和前额皮质的锥体神经元的神经突(spine)密度减少,但海马区没有。突触标记物synaptophysin、syntaxin和PSD-95随着小鼠月龄增长而表达降低。
6、LTP / LTD的变化
虽然可以在野生型小鼠的第V层神经元中诱导脉冲时序依赖性长时程增强(STD-LTP),但是同样的刺激流程会在5xFAD小鼠的神经元中诱导长时程抑制(LTD)。
7、认知障碍
空间工作记忆受损和焦虑减少在3至6个月之间出现并随着年龄加重。
(二)表型详情
1、神经病理
表达FAD基因APP和PS1突变的转基因小鼠可过表达Aβ42,表现出与AD疾病过程相似的淀粉样蛋白病理,但大多类似的模型产生斑块需要的时间较长。5XFAD小鼠是同时表达五个家族性AD突变基因的APP/PS1双转基因小鼠模型,此品系模型小鼠可表达大量Aβ42,在2月龄出现大脑淀粉样蛋白和胶质增生病理表型。淀粉样病理早期出现且较严重的是海马下托(Subiculum)和皮层第V层。在年轻至16天的动物中,免疫组织化学手段在海马下托和第V层锥体神经元中检测到人类APP,并且6周时在这些神经元中观察到细胞内Aβ(Richard et al., 2015)。在2月龄的动物中,免疫组织化学检测到海马、皮层和丘脑的细胞外淀粉样斑块(Richard et al., 2015)。在3月龄时,脊髓中也观察到细胞内Aβ和细胞外斑块,这是被检出的小的年龄(Jawhar et al., 2012)。前额叶、顶叶、内嗅皮层和齿状回中的硫黄素S(Thioflavin-S)阳性斑块在2至4月龄之间出现(Giannoni et al., 2016)。在5xFAD小鼠中发现的斑块含有N-末端截断的Aβ(Guzmán et al., 2014; Savastano et al., 2015; Wirths et al., 2017)。

这个模型中的营养不良性神经突(dystrophic neurites)(Jawhar et al., 2012)、小胶质细胞增生和星形胶质细胞增生与淀粉样斑块相关。
小鼠出现渐进性脑部淀粉样血管病(progressive cerebral amyloid angiopathy, CAA),开始于大约3月龄(Giannoni et al., 2016)。在5xFAD和野生型小鼠的大脑中,微小血管泄漏随着年龄的增长而增加,但在转基因动物中更严重。虽然微血管损伤很常见,但与微血管周围小胶质细胞增生、淀粉样沉积物相关的很少。
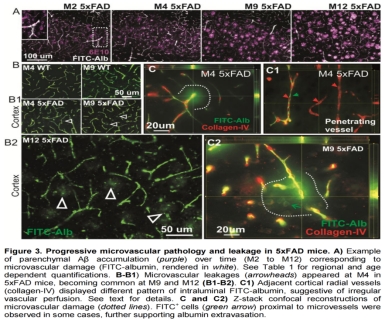
在与表达黄色荧光蛋白(YFP)的小鼠进行交配的5xFAD小鼠中观察到特定突触的丢失。与仅表达YFP的小鼠相比,6月龄的5xFAD-YFP小鼠的体感和前额皮质锥体神经元中的神经突密度减小,但海马中并未减少(Crowe和Ellis-Davies,2013)。
5xFAD小鼠中的第V层锥体神经元数量下降约40%,但(前额)皮层整体和海马CA1中的神经元数量与野生型小鼠没有区别(Jawhar et al., 2012)。

在小鼠1月龄时,就存在髓鞘异常,并且随着年龄的增长变得更加严重。1月龄时,在5xFAD小鼠的多个脑区域中,与野生型小鼠相比,看到了髓鞘基础蛋白的水平降低(Wu et al., 2018),以及髓鞘的减少(Gu et al., 2018)。髓鞘随着年龄变得更薄,形态上异常的髓鞘(髓鞘分裂、轴突具有两层髓鞘,髓鞘外折、髓鞘鼓胀)在转基因小鼠中更早出现并更频繁(Gu et al., 2018)。在这种模型中,轴突也受到影响:2至3月龄的CA1和感觉皮层中的轴突直径减小(Gu et al., 2018),并在3月龄的小鼠中观察到多个脑区的轴突肿胀,表明轴突正在退化,与斑块无关(Jawhar et al., 2012; Richard et al., 2015)。
2、电生理
从8至12周的小鼠中获得了突触缺陷的电生理证据(Buskila et al., 2013)。第V层神经元的微型兴奋性突触后电流(miniature excitatory postsynaptic currents, mEPSCs)的频率和幅度降低,分别反映了突触前和突触后的功能障碍。第V层神经元还显示出异常的突触可塑性:虽然野生型小鼠的第V层神经元诱导了脉冲时序依赖性长时程增强(spike-timing-dependent long-term potentiation, STD-LTP),但是同样的刺激流程在5xFAD小鼠的神经元中诱导了长时程抑制(long-term depression, LTD)。尽管II / III层中神经元的特性在不同基因型之间没有区别,但5xFAD小鼠的第V层神经元更难被激活。
3、行为
4-5月龄5XFAD小鼠与对照组相比表现出Y迷宫自发交替行为(spontaneous alternation performance)的学习记忆下降。Y迷宫进入迷宫臂的总次数无明显差异,提示5XFAD小鼠的运动功能和探索能力正常。5XFAD小鼠在线索和环境的条件恐惧记忆实验表现出学习记忆能力下降。5XFAD小鼠在水迷宫实验,以及其他海马依赖的记忆实验中也表现出学习记忆能力的下降。
在十字迷宫测试中评估的空间工作记忆障碍在3至6月龄之间出现,并随着年龄的增长而恶化(Jawhar et al., 2012)。(十字迷宫测试类似于但可能比Y迷宫更敏感,因为测试设备由四个臂组成而不是三个。与Y迷宫相似,在十字迷宫中的自发转向用于评估工作记忆。)探索行为(入臂总次数)在5xFAD和野生型小鼠中至少直到12月龄不变。焦虑的逐渐减少(在高架十字迷宫中测量),在3至6个月之间出现。5xFAD小鼠的焦虑减少在旷场实验(open field)也可以看到,但在这个测试中,转基因小鼠与野生型小鼠之间的差异直到9至12个月后才出现。在开放场地中的运动能力(locomotor activity)在至少12个月内正常(Jawhar et al., 2012)。
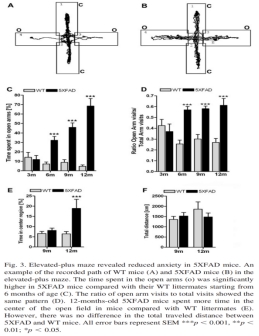
一组报告称至少到2月龄的水迷宫中的空间记忆功能正常(Richard et al., 2015),而第二组报告称,在一个月大的小鼠中就出现了水迷宫中的记忆障碍(Gu et al., 2018; Wu et al., 2018)。这种差异可以追溯到记忆障碍的定义方式不同。一组的结论是记忆功能正常,因为转基因小鼠在探索试验中对目标象限表现出明显的偏好(即小鼠在训练试验期间,在水池的逃生平台所在象限中度过测试的25%以上)。第二组比较了5xFAD和野生型小鼠之间的目标象限占用率,并发现转基因小鼠在目标象限中花费的时间略微较少,尽管两种基因型似乎都偏爱该象限。此外,使用第二个测量标准 - 平台穿越次数 - 5xFAD小鼠与野生型小鼠之间存在小、但具有统计学意义的差异。
在9月龄的小鼠中观察到平衡木(balance-beam)和绳悬挂(string-suspension)测试中的感觉运动缺陷(Jawhar et al., 2012)。
反射异常,具体表现为尾悬挂测试中的后肢和前肢紧握,在5个月大的小鼠中发现(Richard et al., 2015)。
4、组学
在2至4个月的年龄段,5xFAD和野生型小鼠的海马中的差异表达基因数量激增 - 从2个月的42个转录本增加到4个月的1,300个以上(Bundy et al., 2018)。


基因分类 (Gene Ontology) 分析表明,在4个月的5xFAD中上调的基因与免疫激活相关。在雌性(766)中,发现的差异表达基因多于雄性(537)。在4个月的5xFAD中,相对于雄性,雌性发现略微增加了人类APP和PSEN1 mRNA的水平。
5、其它
锰增强磁共振成像(MEMRI)已被用于绘制5xFAD小鼠大脑区域活动图谱 (Tang et al., 2016; Nie et al., 2019). 。在转基因和野生型小鼠之间看到了年龄依赖性的区域特异性差异,转基因小鼠的海马区和杏仁核区的活动在1至5月龄(用于研究的大月龄)期间一直升高。与野生型小鼠相比,5xFAD小鼠的体重降低 (Jawhar et al., 2012; Richard et al., 2015).
四、繁育饲养
繁殖注意事项
半合子 x F1
雄x雌:杂合 x C57BL/6J (000664)
雄x雌:C57BL/6J (000664) x 杂合
当维持一个活体种群时,杂合小鼠可以与C57BL/6J小鼠(JAX编号00664)进行繁殖。
饲料:鼠繁殖饲料
五、 订购方式
我们提供spf级APP/PS1、3xtg-AD、5xFad。
公司优势:
· 可提供现货,高效率配合客户的课题研究;
· 饲养人员经验丰富,可有效预防小鼠打斗,并保证动物状态健康;
· 控制饲养密度;
· 饲养以及运输时不混装不同笼盒小鼠;
· 换笼时留下原有气味,安抚小鼠,不更换同伴。定期进行健康监测季度环境检测。小鼠发货附合格证,严格按客户实际要求月龄发货,环境条件一致,均一性好。