阿尔茨海默病(AD)小鼠模型
一、疾病概述
阿尔茨海默病(Alzheimer's disease,AD)是一种起病隐匿的进行性发展的神经系统退行性疾病,一般可分为早发性 (EOAD) 和迟发性 (LOAD)。阿尔兹海默病临床症状主要为记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现,起病隐匿,呈进行性发展,但目前其病因和发病机制仍不明确。 病理表现主要为脑组织萎缩、神经纤维缠结、老年斑形成和大量淀粉样蛋白沉积。 发病机制尚不明确,从目前研究来看,该病的可能因素和假说多达30余种,主要发病机制假说包括Aβ毒性假说,Tau蛋白代谢异常,神经炎症,胆碱能损伤,金属离子代谢紊乱,糖脂代谢紊乱,自由基损伤,神经血管功能失调,线粒体功能紊乱,兴奋性氨基酸毒性、病毒感染等。
二、双转鼠—— APP/ PS 1小鼠 (C57BL/ 6;C3H背景)
(一)遗传背景:C57BL/6;C3H

(二)毛色:黑色/棕色(APP本身有两种毛色,遗传背景一致)
(三)转基因: APP、PSEN1
(四)构建策略:朊病毒蛋白启动子驱动下表达突变的人类早老素1(PS1-dE9)和人鼠淀粉样前蛋白(APPswe)融合体。
突变的APP:KM670/671NL(瑞典)
突变的PSEN1:deltaE9
PS1-dE9的共表达极大地加速了APPswe转基因小鼠的淀粉样蛋白病理。
APPPS1 小鼠含有携带 Swedish 突变的 APP 和含有 L166P 突变的 PSEN1 的人类转基因,两者都在 Thy1 启动子的控制下。在这些小鼠中,人APP转基因的表达量比内源性小鼠APP高约3倍。在大脑中,Aβ42 / Aβ40随着淀粉样蛋白沉积的开始而降低(Radde等人,2006;Maia等人,2013)。淀粉样斑块沉积在大约六周龄时开始于新皮层。沉积物在大约三到四个月时出现在海马体中,在四到五个月时出现在纹状体、丘脑和脑干中。在所有嗜胶淀粉样蛋白沉积物附近均观察到磷酸化的 tau 阳性神经炎过程,但未见纤维状tau包涵体。
在这些小鼠中也广泛检查了Aβ和tau的CSF水平(Maia等人,2013)。这些小鼠脑脊液中的Aβ42浓度随着年龄的增长而降低,到6个月大时减少50%,到18个月时减少80%。Aβ40浓度也会降低,但幅度较小(18个月时降低45%)。这些动物的脑脊液总tau蛋白浓度增加,从6个月开始,到18个月大时达到5倍。
有份描述这些小鼠的出版物报告说,它们在八个月大时表现出对食物奖励的四臂空间迷宫任务的反向学习受损(Radde等人,2006)。其他人随后报告了认知障碍的早期观察结果,包括七个月大时莫里斯水迷宫的缺陷(Serneels 等人,2009 年)。据报道,海马CA1区域LTP的损伤也在这个年龄左右开始(Gengler等人,2010)。
在APPPS1小鼠中未观察到整体神经元丢失,但在齿状回的颗粒细胞层和其他具有高神经元密度的亚区域中发现适度的神经元丢失,例如17个月(Rupp等人,2011)。

Jankowsky JL., Hum Mol Genet, 2004
(五)特征:
①斑块沉积:Aβ沉积在皮层的6周龄和海马体的3-4个月大时开始。6个月开始形成Ab,到9个月时海马和皮层有大量斑块,斑块持续增加直至约12个月。
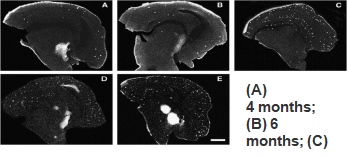
Garcia-Alloza et al., Neurobiol Dis., 2006
②神经元丢失:8个月开始出现神经丢失。未观察到全局神经元丢失,但在齿状回的颗粒细胞层和17个月大动物中具有高神经元密度的其他亚区域中发现了适度的神经元丢失(Rupp等人,2011)。
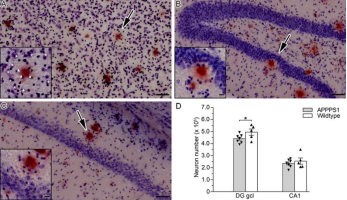
Rupp et al., Neurobiol. Aging, 2011
③神经胶质增生:6周时Aβ沉积物周围的小胶质细胞被激活,星形胶质细胞增多(Radde等人,2006)。CCL2和TNFα的水平在以后的年龄增加(Lee等人,2010)。3个月内存在的胶质较少,6个月后在斑块附近大量聚集。

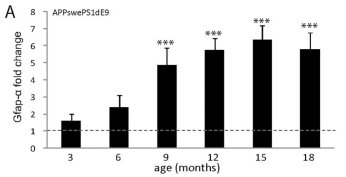
Kamphuis et al., PLoS One. 2012
④突触缺失:在4个月时,小鼠海马区的突触素、突触结合蛋白等存在丢失。
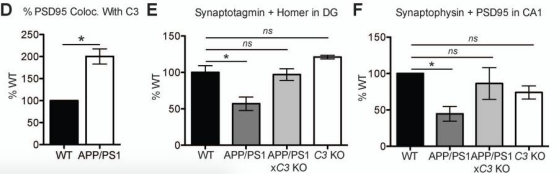
Hong et al., Science, 2016
⑤缠结:已观察到斑块周围的磷酸化tau阳性神经炎过程,但没有成熟的缠结(Radde等人,2006)。
⑥LTP/LTD改变:3个月时会开始出现短暂的长时程增强作用,一直持续到12个月。海马 CA1 LTP 在 4.5 个月大时正常,但在8个月和15个月大时受损(Gengler 等人,2010年)。
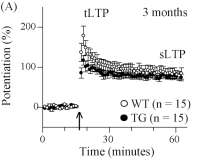
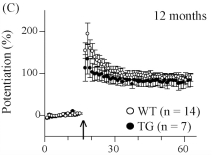
⑦认知损伤:直至12-13个月时空间记忆才出现赤字
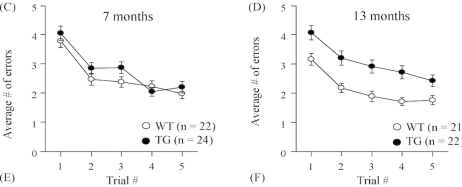
⑧APP/PS1转基因小鼠行为学表现
认知障碍(如空间记忆和上下文记忆缺陷)。自发行为改变(例如:筑巢、挖洞)。在7个月时报告的莫里斯水迷宫中空间学习和记忆的认知缺陷(Serneels 等人,2009年)。在 8 个月时观察到食物奖励的四臂空间迷宫任务的逆转学习受损(Radde 等人,2006 年)。Morris水迷宫实验发现3、6、9月龄APP/PS1转基因小鼠空间探索实验结果与同月龄野生型小鼠相比具有显著差异,学习及记忆能力显著降低(P<0.05)。
(六)实验动物背景信息
APP基因位于染色体21q11.2-22.2上,由18个外显子和17个内含子组成。基因产物为跨膜糖蛋白,由APP基因通过选择性剪切翻译而成。APP至少有六种剪接形式,长度分别为365、563、695、714、751、770个氨基酸残基,其中695、751和770为主要形式。APP695主要在大脑表达,尤其在AD病人的海马回和皮层中APP695与APP751的比率异常,且与脑中这些部位斑块的数量呈正相关。由APP编码的APP蛋白经过加工水解可产生β淀粉样蛋白(β amyloid, Aβ)。病理情况下,APP经过β分泌酶和γ分泌酶分解生成Aβ40和Aβ42,其中Aβ42与AD患者脑中Aβ沉积和神经元的变性密切相关。在家族性AD患者中已鉴定出多个APP基因的突变位点。其中大部分突变位于外显子16和17的分泌酶裂解位点或APP跨膜区,如APP瑞典突变(APPswe:APP K670N和M671L)和伦敦突变(APPlon:APPV717I)。APP突变可改变APP的加工过程,导致具有神经毒性作用的Aβ42产生,引发多种病理机制,促使神经细胞凋亡或死亡,而导致AD的发生。
PS1基因位于14号染色体,共10个外显子。PS1基因编码的PS蛋白为γ分泌酶的重要组成部分,在生成Aβ的过程中起重要作用。PS1突变是引起家族性AD的主要原因之一。PS1突变使其编码的蛋白亲水性环状结构域缺失,导致其构象改变,可影响γ-分泌酶的活性,使Aβ42生成增多。
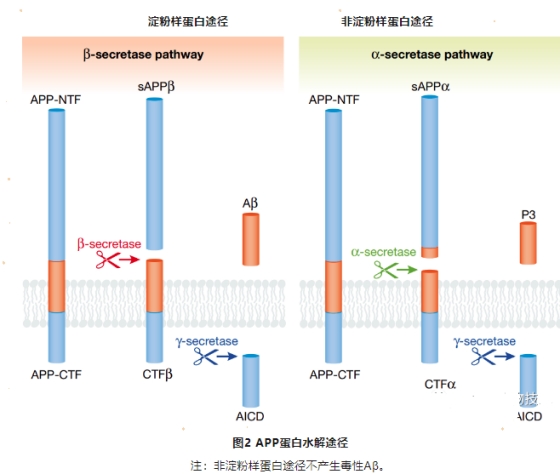
三、Aβ产生途径
Aβ是由 APP (Amyloid Precursor Protein) 依序水解产生的。在APP淀粉样蛋白加工过程中,β-分泌酶先将APP切割成膜连接的CTFβ和N端sAPPβ。随后,CTFβ被γ-分泌酶切割成AICD和一系列氨基酸片段。γ-分泌酶可以在多个位点切割APP,因此这些氨基酸片段会被进一步水解加工成Aβ肽的形式:如Aβ40和Aβ42。其中,Aβ42具有高度疏水性并易于聚集,是具致病性的形式。
导致阿尔兹海默病的常见基因突变
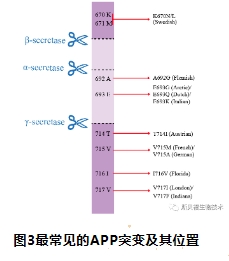
目前为止,被报道过的APP突变位点主要分布在第16及17外显子,这些突变可引起APP蛋白表达异常或水解改变,从而增加CTFs、总Aβ、Aβ42含量或改变Aβ42/Aβ40的比值。突变的命名是根据一个确定的家族地理起源和 APP770 中的突变残基位置编号确定的。
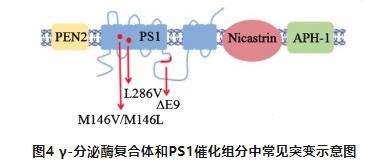
PS1是组成γ-分泌酶蛋白质复合物的一部分,该基因的错义突变会影响γ-分泌酶的持续合成能力进而导致产生Aβ42的量增多以及Aβ42/Aβ40比率的变化。其中M146V、M146L、L286V 和△E9会比其他突变产生更多的Aβ42。
四、阿尔茨海默症小鼠行为学验证实验
阿尔茨海默症小鼠行为学验证的方法很多,这里主要介绍两种方法:Morris 水迷宫测试和避暗实验。
1、 Morris 水迷宫测试
Morris 水迷宫中黑色水池直径150cm,高60cm。方形透明平台(10×10×28cm)或圆形透明平台(直径8cm)。圆桶中注入45cm 高的自来水,平台位于水面下1cm。水温维持在20-22° C ,水中加入黑色无毒染料进行混匀使平台隐蔽。
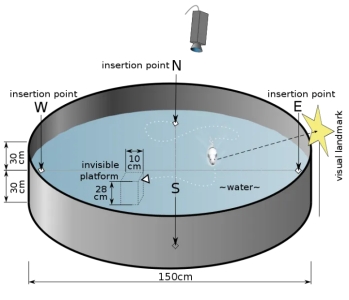
● 实验将水面等分为 4 个象限,其中一个象限为目标象限。水池上的视频采集系统同步记录小鼠游泳轨迹,并以 ANY-maze 行为学分析软件分析。
实验开始前 1天小鼠置于水迷宫实验室以适应周围环境。在前 5 天的定位航行实验中,每天测试 4 次,均从不同的象限入水。每轮实验将小鼠从设定的入水点面向池壁放入水中。如果 60s 内实验小鼠爬上隐蔽站台,并在站台上停留时间超过 5S,视为找到平台。
● 从入水到寻台成功的时间记录为逃避潜伏期。如果小鼠在 60s 内没有寻找到平台,将会引导其至平台上并驻留 10s,逃避潜伏期记录为 60s。计算每天 4 次逃避潜伏期的平均值为平均逃避潜伏期。
● 在第 6 天的空间探索实验中,水下的平台被撤去,选择平台对面的象限作为入水点,记录小鼠在 60s 内穿越原平台位置的次数为穿越平台次数,作为反映小鼠空间记忆能力的指标。
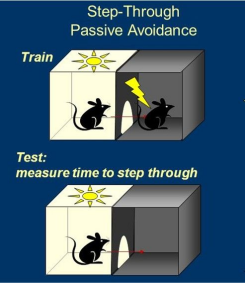
2、避暗实验
● 避暗实验是利用小鼠有很强的探究行为,喜暗恶光的习性。避暗箱包括左右两个同等大小的隔室,暗箱一侧的栅栏地板与刺激器相联,并可给予电击。明箱一侧则不与刺激器相联,故没有电流通过。小鼠进入暗箱即受到电击。
● 避暗实验分为三个阶段。⑴适应期:每只小鼠放进明箱后先适应5min,暗箱不通电,可在明暗箱之间自由活动。⑵训练期期间,小鼠(四肢)完全进入暗箱后,立即将中门关上,并给予一次电击。电击后让小鼠在暗箱内停留 10s,使小鼠形成暗箱与电击之间的联系。将实验小鼠放回原笼,清洁操作箱。⑶记忆保持测试期,小鼠电刺激训练结束 1h 和 24 h后,小鼠放回明箱,中门打开,不给电击。
● 录像系统和图像分析系统记录如下数据:
避暗潜伏期:小鼠初次进入暗箱并被电击的时间。3 min 内未进入暗室的小鼠其潜伏期按 180s。计算潜伏期越长,反映动物记忆越好。
避暗错误次数:3min内,小鼠总共进入暗箱并被电击的次数。
————————————————————————————
相关文章
1、宗园媛,王晓映,王海林,刘亚莉,黄澜,马春梅,张连峰,秦川. APP/PS双转基因阿尔茨海默病小鼠模型的老年斑及行为学动态分析[J]. 中国比较医学杂志. 2008. 18(9).
2、宋楠,张玲,陈巍,张倩,韩云林,秦川. 矢车菊素-3-葡萄糖苷对APPswe/PS1ΔE9阿尔茨海默病模型小鼠糖脂代谢的影响[J]. 中国比较医学杂志. 2016,26(7):15-23.
3、朱皓,高凯,张连峰. 阿尔兹海默病小鼠模型的磁共振影像学分析[J].中国比较医学杂志. 2012,(12):48-53.
4、史长华,张玲,陈巍,付信靖,秦川. RNA-Seq 技术筛选APP/PS1阿尔茨海默病模型小鼠差异表达基因及功能分析[J].中国比较医学杂志. 2018,28(10):1-7.
5、梁良. 中药I号方对阿尔兹海默病的多靶位治疗作用[J].中国比较医学杂志. 2013,23(5).
6、秦川,吴善球,陈保生,吴小闲,屈焜耀,刘军民,张桂芳,徐艳峰,舒顺利,孙丽华,李彦红,朱华,黃澜,马春梅,徐玉环,韩云林,卢耀增. 灵芝制剂治疗APP/PS-1阿尔茨海默病转基因小鼠模型的病理学改变[J].中国医学科学院学报. 2017年第4期.
7、Ling Zhang, Ying Wang, Xia Xiayu, Changhua Shi, Wei Chen, Nan Song, Xinjing Fu, Rui Zhou, Yan-Feng Xu, Lan Huang, Hua Zhu, Yunlin Han and Chuan Qin∗. Altered Gut Microbiota in a Mouse Model of Alzheimer’s Disease[J]. Journal of Alzheimer’s Disease 60 (2017) 1241–1257.
8、Yan Liu, Yan-Feng Xu, Ling Zhang, Lan Huang, Pin Yu, Hua Zhu, Wei Deng, Chuan Qin∗. Effective expression of Drebrin in hippocampus improves cognitive function and alleviates lesions of Alzheimer’s disease in APP (swe)/PS1 (ΔE9) mice[J]. CNS Neurosci Ther.2017Jul;23(7):590-604.
9、Radde R, Bolmont T, Kaeser SA, Coomaraswamy J, Lindau D, Stoltze L, Calhoun ME, Jäggi F, Wolburg H, Gengler S, Haass C, Ghetti B, Czech C, Hölscher C, Mathews PM, Jucker M. Abeta42-driven cerebral amyloidosis in transgenic mice reveals early and robust pathology. EMBO Rep. 2006 Sep;7(9):940-6. PubMed.
10、Maia LF, Kaeser SA, Reichwald J, Hruscha M, Martus P, Staufenbiel M, Jucker M. Changes in amyloid-β and Tau in the cerebrospinal fluid of transgenic mice overexpressing amyloid precursor protein. Sci Transl Med. 2013 Jul 17;5(194):194re2. PubMed.
11、Serneels L, Van Biervliet J, Craessaerts K, Dejaegere T, Horré K, Van Houtvin T, Esselmann H, Paul S, Schäfer MK, Berezovska O, Hyman BT, Sprangers B, Sciot R, Moons L, Jucker M, Yang Z, May PC, Karran E, Wiltfang J, D'Hooge R, De Strooper B. gamma-Secretase heterogeneity in the Aph1 subunit: relevance for Alzheimer's disease. Science. 2009 May 1;324(5927):639-42. Epub 2009 Mar 19 PubMed.
12、Gengler S, Hamilton A, Hölscher C. Synaptic plasticity in the hippocampus of a APP/PS1 mouse model of Alzheimer's disease is impaired in old but not young mice. PLoS One. 2010;5(3):e9764. PubMed.
13、Rupp NJ, Wegenast-Braun BM, Radde R, Calhoun ME, Jucker M. Early onset amyloid lesions lead to severe neuritic abnormalities and local, but not global neuron loss in APPPS1 transgenic mice. Neurobiol Aging. 2011 Dec;32(12):2324.e1-6. PubMed.